近年、ケミカルバイオロジー(Chemical Biology)と名付けられた研究分野が新しい分野として特に欧米で注目を集めるようになっています。 ケミカルバイオロジーとは、化学を用いた生物学研究であり、化合物合成等の化学を用いた実験材料の開発を突破口として生物学研究に取り組む研究です。
ケミカルバイオロジーの研究において重要な点は、開発した化学ツールが本当に生物学研究に使うことができるかどうかです。 私たちの研究室では、本当に生物学へ応用できるかどうかというハードルを研究内容に課すことで、新しい研究材料を創り出すことを目指しています。
近年盛んになっている科学研究の潮流の一つに境界領域研究が挙げられます。これは物理学、化学、生物学などの垣根を取り払った融合研究です。 また近年、生命科学研究は大きく進歩し、科学研究全体をリードしています。私たちの研究室では化学を基本として、この生命科学研究に取り組もうとしています。 そして、私たちの研究室は物理学、化学、生物学の融合研究を推進するために最適な環境を用意しています。 当研究室で基本となる学問は化学ですが、必要に応じ生物学や物理学の勉強も行います。 つまり、応用性を見据えることで、複数の分野にまたがる幅広い知識や経験が身に付くと考えています。
本研究室では、研究は自己表現の場であると考えています。 言い換えれば、自分で考えたことを実験して示すことができることが研究生活の醍醐味です。 自分独自の考えを実践できることが研究を行う大きなモチベーションとなり、生まれてくる結果が一般的なものであればこれ以上の喜びはありません。 もちろん、上手くいくことは多くはないので、へこたれないで常に前向きにものを考えることは重要です。しかし、よく考えて努力をしていれば結果は必ずついてくるものです。 化学を用いた生命科学研究に興味のある方は,是非門戸をたたいてみてください。

生化学の発展とゲノム解読の進行により生体内での情報伝達物質やその物質を認識する分子が次々と同定されるようになりました。
現在ではポストゲノムと言う言葉が汎用されますが、この時代には、次の目標である生理的条件での機能の解明が重要視されます。
これまでの生物学では、動物を解剖したり、細胞をすりつぶしたりして、生体分子の機能を調べていました。
一方、動物や細胞が生きたまま生体分子の機能を調べることができればより多くの情報が得られると考えられます。
そこで、私たちは、ケミカルバイオロジー(Chemical Biology)のアプローチを用いて、この問題に取り組んでいます。
これまで、生体分子の反応を実用的なレベルで捉えるプローブ分子はほとんどなく、今後の検討課題となっていました。
私たちは、細胞内分子と特異的に反応して可視化することができるプローブ分子をデザイン・有機合成し、直接生物学研究に応用しています。
言い換えれば、生体内分子と出会うことで蛍光の強さや色が変化する分子やMRIコントラストが変化する分子をデザインします。
つまり、分子をデザインする発想が鍵技術の創製へと繋がると考え、生体内分子の情報を読み取り可能な化学情報へと変換できるプローブ分子の化学合成・開発を目指しています。
具体的には、以下のプロジェクトに取り組んでいます。
| 生体内の細胞機能を可視化する蛍光プローブの開発 |
|---|
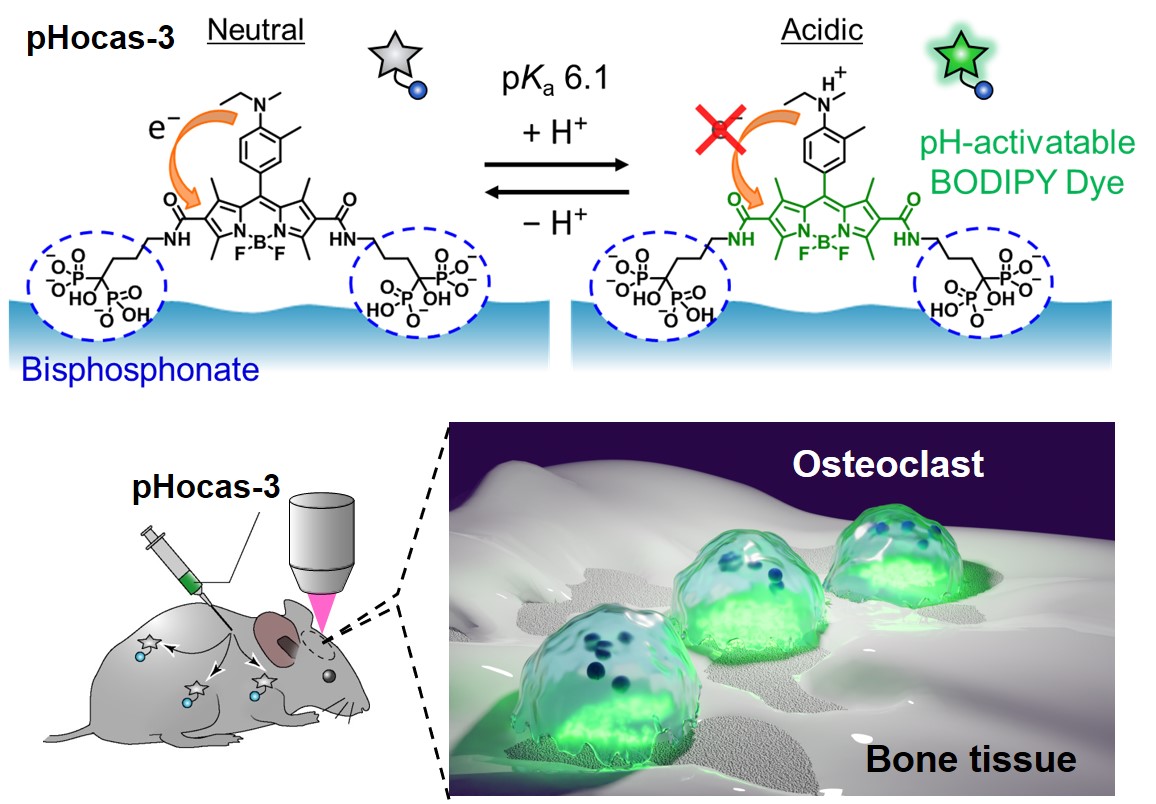
生体内における細胞機能の可視化は、基礎研究のみならず遺伝子治療などの医療応用にも関わる重要な技術であり、現在大きな注目を集めています。 しかしながら、生きた個体内でこのような細胞機能に関わる分子を検出する実用的なプローブはほとんどなく、その開発が期待されています。 私たちは、これまでに骨を溶かす細胞(破骨細胞)の活性を生体内で検出する蛍光プローブを開発し、その機能を明らかにしています。 骨組織における破骨細胞の異常な活性は、骨が脆くなる骨粗しょう症などの疾患につながることが知られています。 これまでは破骨細胞を象牙質切片上で培養し、溶かされたへこみによって破骨細胞の活性が調べられてきました。しかし、この手法では経時的、定量的な解析ができません。 そこで、動物個体の骨組織で破骨細胞活性を直接イメージングできる蛍光プローブを開発しました(図1)。 活性化された破骨細胞は酸を放出して骨を溶かしているため、蛍光プローブには酸性環境で光る蛍光色素を用いています。 加えて、骨組織に送達されるビスホスホネートという構造が導入されています。したがって、破骨細胞が溶かしている骨の領域を選択的に光らせることができます。 この蛍光プローブをマウスに投与し、骨の内部まで観察できる二光子励起顕微鏡を用いて観察すると、破骨細胞と骨表面との間から蛍光シグナルが観察され、溶かされている骨の領域を検出することができました。 長時間の観察のために、光安定性を向上させた色素を用いることで、破骨細胞の動きに合わせて骨が溶けていく様子をリアルタイムで観察することに成功しました。 破骨細胞活性の定量評価も可能であり、骨粗しょう症や関節リウマチといった破骨細胞が関わる疾患の治療薬の開発につながるものと期待されます。
| タンパク質の蛍光ラベル化法の開発 |
|---|
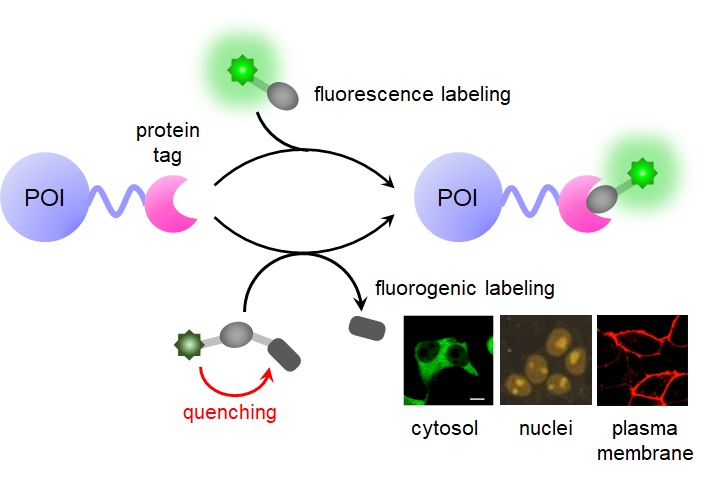
タンパク質の生体内における局在や動態、相互作用をリアルタイムで可視化することは、その機能を詳細に明らかにする上で極めて重要とされています。 この技術の代表例は、2008年のノーベル賞受賞対象になった蛍光タンパク質を利用した方法です。 蛍光タンパク質は、その名の通り、タンパク質そのものが蛍光を発する特徴を持っています。 蛍光タンパク質を見たいタンパク質につなぐことにより、様々なタンパク質の生体内における機能が可視化され、明らかになってきました。 しかしながら、蛍光タンパク質はラベル化するタイミングや量を制御することができないなどの弱点を持っていることが分かってきました。 そこで、私たちは蛍光タンパク質に代わる新しい方法として、合成蛍光プローブとそれに特異的に結合するタンパク質を利用した蛍光ラベル化する技術を開発しています(図2)。 この蛍光ラベル化法では、タグとなるタンパク質(タグタンパク質)を遺伝子工学により見たいタンパク質に融合させて細胞内で発現させます。 次に、タグタンパク質に特異的に結合する蛍光プローブにより蛍光ラベル化し、その結果、融合させた標的タンパク質を蛍光検出します。 近年1分子イメージング、超解像イメージングといった最先端のイメージング手法において、タグタンパク質を用いたラベル化法の有用性が示されており、注目を集めています。

| MRIプローブの開発 |
|---|
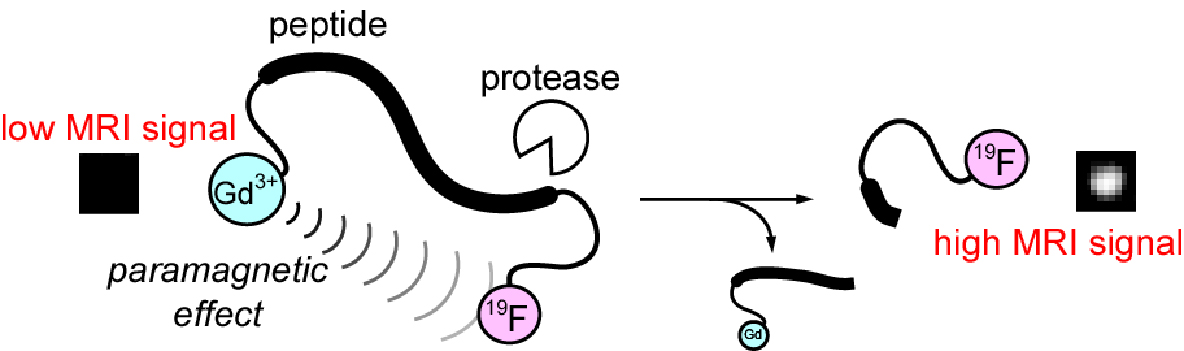
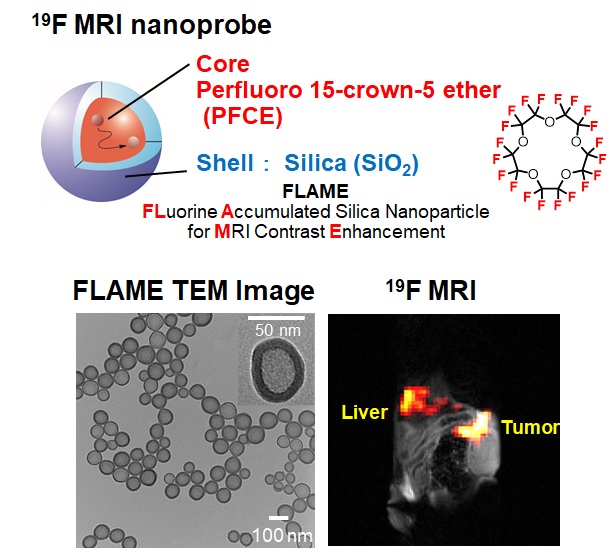
しかしながら、in vivoで酵素反応活性を検出するためには、低分子のプローブでは感度が低くなってしまうという問題点がありました。 そこで、私たちはフッ素化合物を内包したナノ粒子、FLAMEを作製しました(図5)。 このナノ粒子はパーフルオロカーボン(PFC)というフッ素化合物が多数含まれる液体をシリカ(SiO2)の殻で閉じ込めた構造をしています。 PFCはシリカの殻から漏出しないため、中に含まれる多数のフッ素原子由来のシグナルを検出することができます。 この結果、生きたマウス体内でFLAMEの局在を可視化することができ、がん組織に取り込まれたFLAMEのシグナルをイメージングすることに成功しました。 さらに、シリカの表面は機能性分子による修飾が可能です。私たちは、Gd3+錯体を、カスパーゼ切断配列をもつペプチドを介してFLAMEの表面につないだナノ粒子型19F MRIプローブを作製しました。 作製した19F MRIプローブは低分子と同様に、切断によって19FのMRIシグナルが回復します。この19F MRIプローブにより、マウス体内におけるカスパーゼ活性の検出を達成しました。 また、内包するフッ素化合物を変えることで、マルチカラーでナノ粒子型19F MRIプローブの体内動態を追跡することも可能です。 これらの成果はMRIにより生体シグナルを可視化するための基盤技術を提供することができます。
| 光応答性分子の開発と応用 |
|---|

光を照射した際に起こる化学反応を利用し、蛍光イメージングや生理活性物質の放出へ応用する研究も進めています。 ケージド化合物は光で脱保護できる保護基によって生理活性物質や薬剤が保護された化合物であり、光照射によってこれらの分子を特定の場所とタイミングで放出し、細胞機能を制御することができます。 私たちはこれまでに、ケージド膜障害性ペプチドを用いた薬剤放出、ケージドリガンドを用いた転写因子機能の制御を報告してきました。 ケージド化合物の多くは分子の放出に紫外光が必要ですが、可視光を利用できる新たな保護基も最近開発しています。 また、光照射によって分光特性が可逆的に変化する、光スイッチング能を有する蛍光分子の開発も行っています。